Минздрав сообщил о 50 иностранных компаниях, чьи лекарства нарушают качество
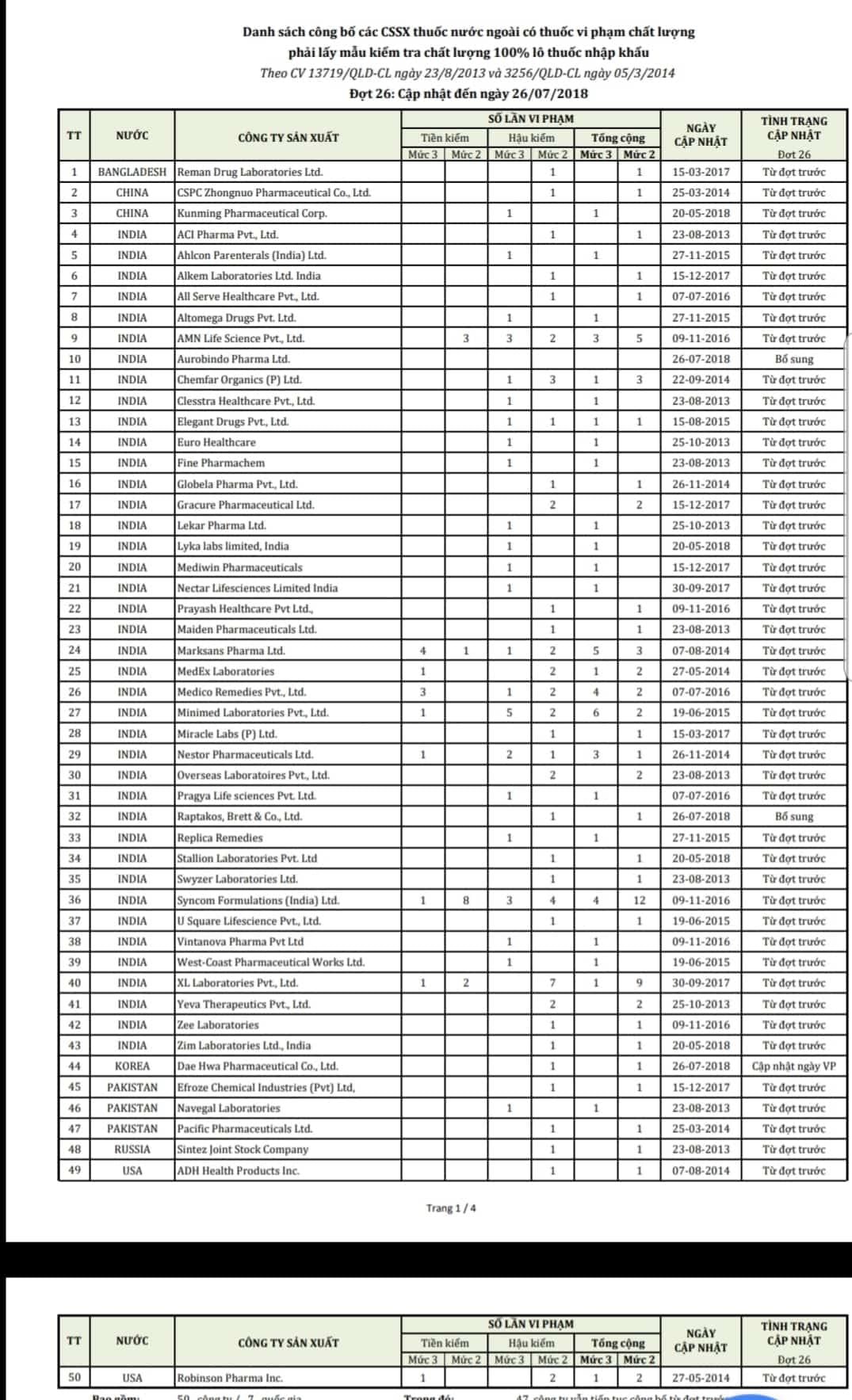
Управление по контролю за лекарственными средствами Министерства здравоохранения Вьетнама только что обнародовало список 50 иностранных компаний, чьи препараты нарушают стандарты качества и которые должны проводить проверку качества 100% импортируемых партий лекарств.
|
| Список 50 иностранных компаний, чьи препараты нарушают качество. |
Департамент по контролю за лекарственными средствами Министерства здравоохранения на основании результатов проверки качества импортируемых лекарственных препаратов в соответствии с нормативными актами только что направил официальное уведомление в департаменты здравоохранения провинций, городов и компании по импорту-экспорту лекарственных препаратов, в котором объявлен список из 50 иностранных компаний, чьи лекарственные препараты нарушают качество, и которые должны провести проверку качества образцов 100% партий импортируемых лекарственных препаратов.
Эти фармацевтические компании принадлежат 7 странам, включая Индию (39 предприятий), Пакистан, Китай, Южную Корею, Россию, США и Бангладеш.
В этом заявлении говорилось, что большинство компаний имели нарушения качества лекарственных препаратов в результате предыдущих проверок, поэтому им пришлось отбирать образцы для проверки качества у 100% импортируемых партий лекарств вместо предписанной постинспекции.
Управление по контролю за лекарственными средствами Вьетнама поручает департаментам здравоохранения провинций и городов центрального подчинения поручить подразделениям по инспекции, контролю и тестированию лекарственных средств проводить проверки и надзор за соблюдением правил контроля качества импортируемых лекарственных средств, находящихся в обращении в зоне управления, а также принимать меры в отношении организаций и лиц, нарушающих правила.
По данным Управления по контролю за лекарственными средствами, перед выпуском препарата на рынок Министерство здравоохранения обязано рассмотреть регистрационное досье, включая сведения о сырье, производственных процессах, стандартах качества, стабильности и клинических данных. Производитель должен соблюдать условия производства (GMP), соблюдать требования утверждённого регистрационного досье на лекарственный препарат в процессе производства и проверять качество на соответствие зарегистрированным стандартам перед выпуском препарата на рынок.
При размещении лекарственных средств на рынке организация, осуществляющая производство/импорт, осуществляет самоконтроль и несет ответственность за качество выпускаемых ею лекарственных средств, сообщает об обнаружении признаков потенциального риска для здоровья потребителей в уполномоченный орган, а также подвергается отбору проб и надзору со стороны уполномоченного органа.
Ежегодно тест-системы отбирают около 40 000 образцов лекарственных средств, представленных на рынке, для контроля качества (в 2015 году было отобрано 38 627 образцов, в 2016 году – 37 219, в 2017 году – 36 362). Доля некачественных препаратов в последние годы составляет около 1,5–2,0%, а доля фальсифицированных – менее 0,05%.