一批次疑似感染疯牛病的医用生物制品紧急暂停使用
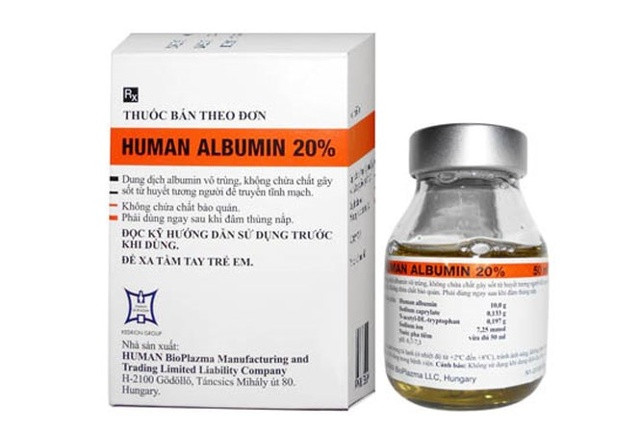
越南药品管理局刚刚宣布,在全国范围内暂停购买、销售和使用一批疑似受到克雅氏病(疯牛病)污染的医用生物制品人血白蛋白20%。
 |
| 插图:互联网 |
据此,卫生部药品监督管理局向各省卫生厅、卫生部直属医院、药品进口和经营企业发出通知,宣布全国范围内暂停购买、销售和使用疑似感染克雅氏病(疯牛病)的医用生物制品人血白蛋白20%批次。
越南药品监督管理局官方通报称,根据欧盟驻越南代表团经济贸易委员会的通报,以及意大利药品管理局和匈牙利国家营养与药学研究所对Kedrion SpA和Human BioPlazma Kft.公司生产的该批血液和血浆提取医用生物制品发出的紧急警告,怀疑该批产品感染了克雅氏病。目前,尚未确认感染克雅氏病以及该克雅氏病菌株。
药品监督管理局还表示,根据平越德有限公司(总部位于胡志明市新平郡第14坊张公亭路62/36号)的报告,上述批次生物制品已进口到越南。具体而言,该产品名为人血白蛋白20%(200克/升),50毫升瓶装,由中央制药股份公司CPC1经销,批号:29610616、29700916、29590616。
为确保使用者安全,在等待药监局配合匈牙利国家营养与药学研究院对20%人血白蛋白、200g/l产品安全性进行检验评估期间,药监局要求卫生部、医院和制药企业暂停购买、销售和使用上述批次的生物制品。
各地方卫生厅紧急通知辖区内各医疗诊疗机构及经营单位,暂停购买、销售和使用上述批次的20%人血白蛋白(200克/升)。同时,各医疗诊疗机构应加强对上述药品不良反应的监测和处理,如有不良反应,应及时报告国家药品信息与不良反应监测中心(地址:河内市还剑区黎圣宗路13-15号)或胡志明市区域药品信息与不良反应监测中心(地址:胡志明市第五郡阮志成路201B号)。
药监局还要求进口、流通企业暂停进口、购买、销售、流通20%人血白蛋白(200g/l)批次,并按照产品标签注明的贮存条件保存;同时,通知经营、治疗机构,对于已经从公司仓库外流通的产品,暂停购买、销售、使用,并按照标签注明的贮存条件保存。
此外,上述企业须于2017年9月20日前汇总库存产品数量并报送药监局。
平越德有限公司与生产商匈牙利 Human BioPlazma 制造与贸易有限责任公司合作,继续监测、更新和报告上述 20% 人血白蛋白生物制品在本国的流通情况,并提供当地管理机构处理该产品的相关信息。
根据TPO
| 相关新闻 |
|---|

