Suspension urgente de l'utilisation d'un lot de produits biologiques médicaux suspectés d'être infectés par la maladie de la vache folle
L'Administration des médicaments du Vietnam vient d'annoncer la suspension temporaire de l'achat, de la vente et de l'utilisation à l'échelle nationale du lot de produit biologique médical Albumine humaine 20% suspecté d'être contaminé par la maladie de Creutzfeld-Jakob (maladie de la vache folle).
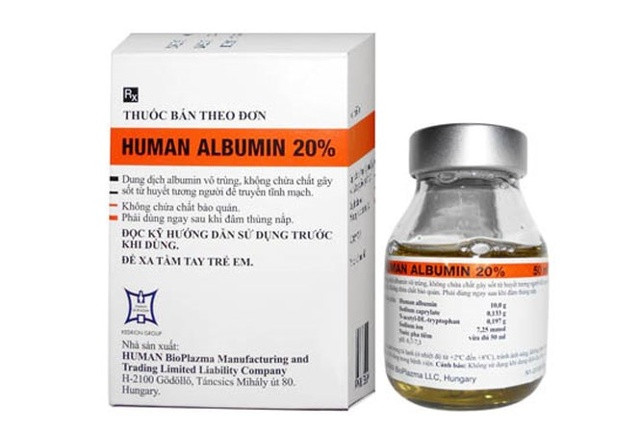 |
| Illustration : Internet |
En conséquence, dans une dépêche officielle envoyée au Département de la Santé des provinces, aux hôpitaux relevant du Ministère de la Santé et aux sociétés d'importation et de distribution de médicaments, le Département de l'Administration des Médicaments - Ministère de la Santé a annoncé la suspension temporaire de l'achat, de la vente et de l'utilisation à l'échelle nationale du lot de produit biologique médical Albumine Humaine 20% en raison d'une suspicion de contamination par la maladie de Creutzfeld-Jakob (maladie de la vache folle).
Le communiqué officiel du Département de l'administration des médicaments indique que, suite à l'annonce du Comité économique et commercial de la délégation de l'Union européenne au Vietnam, ainsi qu'à l'alerte urgente de l'Agence italienne des médicaments et de l'Institut national hongrois de nutrition et de pharmacie concernant le lot de produits biologiques médicaux dérivés du sang et du plasma produits par Kedrion SpA et Human BioPlazma Kft., il existe une suspicion d'infection par la maladie de Creutzfeld-Jakob. À ce jour, l'infection par la maladie de Creutzfeld-Jakob et cette souche de la maladie n'ont pas été confirmées.
L'Agence des médicaments a également indiqué que, selon un rapport de la société Binh Viet Duc Company Limited (dont le siège social est situé au 62/36 Truong Cong Dinh, arrondissement 14, district de Tan Binh, Hô-Chi-Minh-Ville), le lot de produits biologiques susmentionné a été importé au Vietnam. Il s'agit d'albumine humaine 20 % (200 g/l), en flacon de 50 ml, distribué par la société Central Pharmaceutical Joint Stock Company CPC1, sous les numéros de lot suivants : 29610616, 29700916 et 29590616.
Afin de garantir la sécurité des utilisateurs, en attendant que l'Administration des médicaments se coordonne avec l'Institut national hongrois de nutrition et de pharmacie pour inspecter et évaluer la sécurité du produit Albumine humaine 20 %, 200 g/l, l'Administration des médicaments demande au Département de la santé, aux hôpitaux et aux entreprises pharmaceutiques de cesser temporairement d'acheter, de vendre et d'utiliser le lot de produits biologiques ci-dessus.
Le Département de la Santé des localités informe d'urgence les établissements de soins et de diagnostic médical et les entreprises de la zone concernée de suspendre temporairement l'achat, la vente et l'utilisation des lots d'albumine humaine 20 % (200 g/l) susmentionnés. Parallèlement, les établissements de soins et de diagnostic médical doivent renforcer la surveillance et la prise en charge des effets indésirables des médicaments susmentionnés, le cas échéant, et les signaler au Centre national d'information sur les médicaments et de surveillance des effets indésirables des médicaments (13-15 Le Thanh Tong, Hoan Kiem, Hanoï) ou au Centre régional d'information sur les médicaments et de surveillance des effets indésirables des médicaments de Hô-Chi-Minh-Ville (201B Nguyen Chi Thanh, 5e arrondissement, Hô-Chi-Minh-Ville).
L'Administration des médicaments exige également que les sociétés d'importation et de distribution cessent temporairement d'importer, d'acheter, de vendre et de distribuer des lots d'albumine humaine à 20 % (200 g/l) et de les conserver conformément aux conditions de stockage indiquées sur l'étiquette du produit ; Dans le même temps, informez les entreprises et les établissements de traitement de cesser temporairement d'acheter, de vendre, d'utiliser et de conserver le produit conformément aux conditions de stockage indiquées sur l'étiquette au cas où il aurait été distribué hors de l'entrepôt de l'entreprise.
De plus, les entreprises susmentionnées doivent résumer la quantité de produits en stock et en faire rapport à la Drug Administration avant le 20 septembre 2017.
Binh Viet Duc Company Limited coopère avec le fabricant - Human BioPlazma Manufacturing and Trading Limited Liability Company, Hongrie pour continuer à surveiller, mettre à jour et signaler la situation de circulation dans le pays d'origine du produit biologique d'albumine humaine à 20 % mentionné ci-dessus et fournir des informations relatives à la manipulation de ce produit par l'agence de gestion locale.
Selon TPO

