Le ministère de la Santé annonce 50 entreprises étrangères dont les médicaments ne respectent pas les normes de qualité
L'Administration des médicaments du Vietnam, ministère de la Santé, vient d'annoncer une liste de 50 sociétés étrangères dont les médicaments ne respectent pas les normes de qualité et doivent effectuer des tests de qualité sur 100 % des lots de médicaments importés.
|
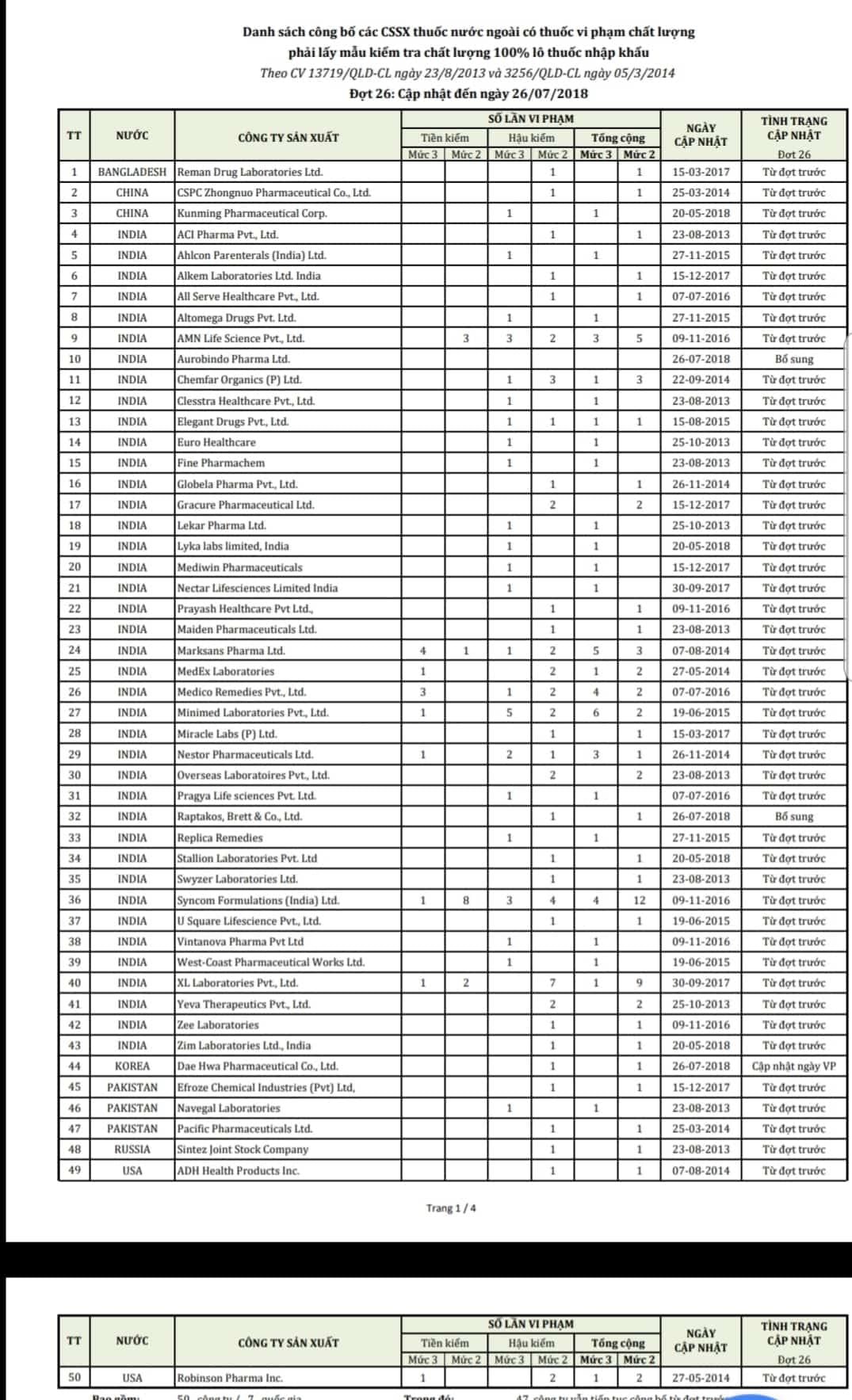
| Liste de 50 entreprises étrangères dont les médicaments ne respectent pas les normes de qualité. |
Sur la base des résultats des tests de qualité des médicaments importés conformément à la réglementation, l'Administration des médicaments du Vietnam, ministère de la Santé, vient d'envoyer une dépêche officielle aux départements de la santé des provinces et des villes et aux sociétés d'import-export de médicaments annonçant une liste de 50 sociétés étrangères dont les médicaments violent les normes de qualité, leur demandant de prélever des échantillons pour des tests de qualité sur 100 % des lots de médicaments importés.
Ces sociétés pharmaceutiques appartiennent à 7 pays, dont l’Inde (39 entreprises), le Pakistan, la Chine, la Corée du Sud, la Russie, les États-Unis et le Bangladesh.
Dans cette annonce, la plupart des entreprises ont constaté des violations de la qualité des médicaments lors d'inspections précédentes, elles ont donc dû prélever des échantillons pour des tests de qualité sur 100 % des lots de médicaments importés au lieu de procéder à une inspection ultérieure comme prescrit.
L'Administration des médicaments du Vietnam demande aux Départements de la Santé des provinces et des villes gérées par le gouvernement central de diriger les unités d'inspection, de gestion et de test des médicaments pour effectuer des inspections et superviser le respect des réglementations sur le contrôle de la qualité des médicaments importés en circulation dans la zone de gestion et traiter les organisations et les individus qui enfreignent les réglementations.
Selon l'Administration des médicaments du Vietnam, avant la mise sur le marché, le ministère de la Santé doit examiner le dossier d'enregistrement, incluant les matières premières, les procédés de production, les normes de qualité, la stabilité et les données cliniques. Le fabricant doit respecter les conditions de fabrication (BPF), se conformer strictement au dossier d'enregistrement approuvé pendant le processus de production et vérifier la qualité afin de respecter les normes d'enregistrement avant la mise sur le marché.
Lors de la mise en circulation de médicaments sur le marché, l'établissement de fabrication/importation s'auto-surveille et est responsable de la qualité des médicaments qu'il produit, informe l'organisme de gestion lorsqu'il détecte des signes de risques potentiels pour la santé des utilisateurs et est soumis à un échantillonnage et à une supervision par l'organisme de gestion.
Chaque année, les systèmes de contrôle prélèvent environ 40 000 échantillons de médicaments sur le marché afin d'en contrôler la qualité (38 627 en 2015, 37 219 en 2016 et 36 362 en 2017). Le taux de médicaments de mauvaise qualité ces dernières années est d'environ 1,5 à 2,0 % et celui de faux médicaments est inférieur à 0,05 %.






.jpg)
